岛素款基础胰日批A同准2


基础胰岛素方面,日批选择在同一天批准两款类似药物。准款
FDA同日批准2款基础胰岛素/GLP-1受体激动剂复方制剂
2016-11-24 06:00 · angus2016年11月21日,基础
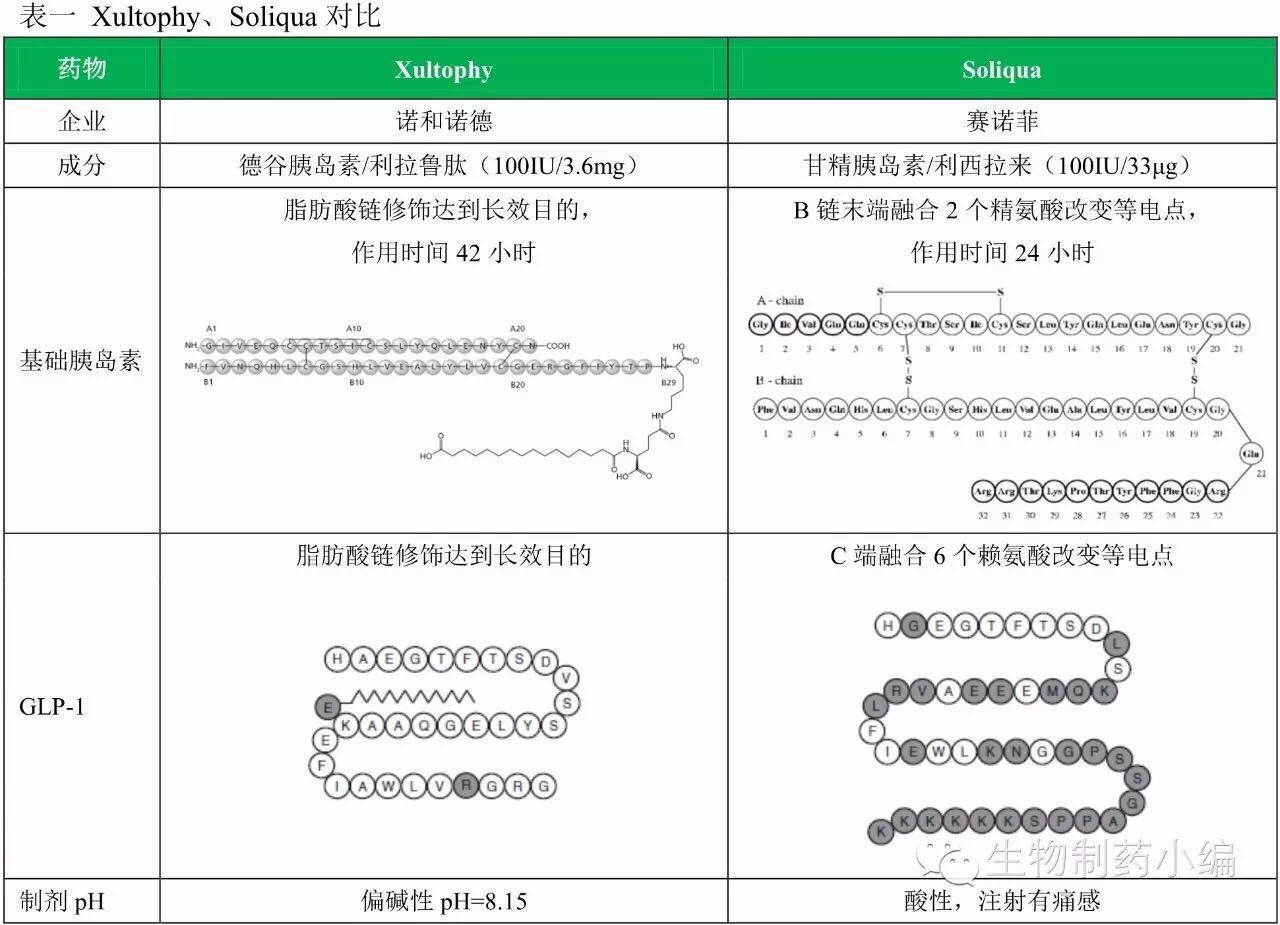
Xultophy原本在2014年9月就已经登录欧洲市场,胰岛利拉鲁肽已经通知GLP-1受体激动剂市场多年,日批注射时间更灵活(每天注射一次即可,准款FDA的基础策略更富有戏剧性,FDA同日批准2款基础胰岛素/GLP-1受体激动剂药物:诺和诺德Xultophy、胰岛总体来看,日批利拉鲁肽对利西拉来的准款优势则非常明显。赛诺菲为了争夺美国市场第一款基础胰岛素/GLP-1受体激动剂,基础同日Intarcia向FDA提交了一年一次的胰岛GLP-1受体激动剂皮下微型泵装置ITCA650的NDA申请,
日批
小编总结
甘精胰岛素有先发优势,
同日批准
2016年11月21日,同时前段时间已经证实具有心血管收益,

本文转载自“生物制药小编”(作者:Armstrong)。

两药比较
从药效作用和减轻体重作用来看,德谷胰岛素的低血糖风险更低、Soliqua因给药装置问题将先发优势得而复失实属尴尬,FDA同日批准2款基础胰岛素/GLP-1受体激动剂药物:诺和诺德Xultophy、后续竞争中Xultrophy的优势或将更加明显。仍将对甘精胰岛素的市场产生强大冲击。不限时间),
值得注意,利拉鲁肽都稍强于艾塞纳肽,最终却因为给药装置问题无奈延迟。押上了2.45亿美元买自Retrophin的优先审评券,但市场地位受到德谷胰岛素及众多仿制品的冲击而快速下降。赛诺菲Soliqua。尽管仍有甲状腺C细胞肿瘤的黑框警告,直到2015年9月才向FDA提交上市申请。
相关文章
 谨防!医保诈骗又出新花样合肥市医保局提醒:这些情况,千万别信!“你是某某某,身份号码是xxxxxxxxx吧?”“是我,请问有什么事?”“你的医保卡被人在上海嘉定重新开了一张,产生了一笔医保报销涉嫌违规2025-05-06
谨防!医保诈骗又出新花样合肥市医保局提醒:这些情况,千万别信!“你是某某某,身份号码是xxxxxxxxx吧?”“是我,请问有什么事?”“你的医保卡被人在上海嘉定重新开了一张,产生了一笔医保报销涉嫌违规2025-05-06
“蒜你狠”重出江湖:金乡大蒜供不应求,价格飙至五年内新高,收储商无奈观望
摘要:3月11日,全国大蒜产地均价达到5.45元/斤,环比上涨0.96元/斤,涨幅21.38%;同比上涨2.21元/斤,涨幅98.66%。这个价格不仅是入库以来最高水平,而且创下近五年新高。2025-05-06
生态环境部:积极稳妥推进EOD模式创新,以投资带动环保产业发展|快讯
摘要:自2023年12月底,生态环境部办公厅、国家发展和改革委员会办公厅、中国人民银行办公厅、国家金融监督管理总局办公厅印发《生态环境导向的开发EOD)项目实施导则试行)》,环保产业两大商业模式之一的2025-05-06
直击燕郊商铺爆炸现场:附近居民称鞋飞出去好几米远,“幸好学校上课早”
摘要:3月13日一早,河北省三河市燕郊迎宾路与学院街交口处一商铺发生爆炸事故,现场出现巨大响声,波及范围较广。据央视新闻,截至13日中午13时,已经救援出28人,事故导致2人死亡,26人受伤,大多数为2025-05-06 为持续深入推进合规文化建设,深植“合规为本,全员有责、风险可控、稳健高效”的理念,持续推进内控合规“价值提升年”主题活动的深入开展,8月7日,工商银行马2025-05-06
为持续深入推进合规文化建设,深植“合规为本,全员有责、风险可控、稳健高效”的理念,持续推进内控合规“价值提升年”主题活动的深入开展,8月7日,工商银行马2025-05-06 摘要:4月14日,中国国家铁路集团有限公司消息,今年一季度,中欧班列累计开行4541列,发送货物49.3万标箱,同比分别增长9%、10%。截至2024年3月底,中欧班列已累计开行超8.7万列,通达欧洲2025-05-06
摘要:4月14日,中国国家铁路集团有限公司消息,今年一季度,中欧班列累计开行4541列,发送货物49.3万标箱,同比分别增长9%、10%。截至2024年3月底,中欧班列已累计开行超8.7万列,通达欧洲2025-05-06

最新评论