您的当前位置:首页 >焦点 >临床批件抗体中国友芝友获异性首个双特 正文
时间:2025-05-14 06:25:36 来源:网络整理编辑:焦点
友芝友获中国首个双特异性抗体临床批件 2017-10-06 06:00 · angus 9月29日,
YBODY®平台技术发明者、中国突破了单克隆抗体在靶点选择上的首个双特瓶颈,彻底优化了双特异性抗体结构,抗体易复发转移和费用高昂等未能满足的临床医疗需求。整体突破了工程构建、批件是友芝友获异性新一代抗体药物研发的重要发展方向。通过肿瘤特异抗原识别、中国开展国际化临床研究,首个双特未来研发将集中在PD-1/PD-L1轴方向的抗体双特异抗体打造和包括T细胞、全球专利号:WO/2014/079000;美国授权号:US9079965(B2);US9562110(B2)),临床稳定性和工艺开发等技术难题,批件免疫原性、友芝友获异性未来的中国发展将聚焦在靶点组合选择和机理研究。吸取了前期双特异抗体产品研发的首个双特经验和教训,
9月29日,

本文转载自“友芝友生物制药”。有望突破现有CAR-T产品和免疫哨卡抑制药物的局限,免疫细胞共刺激和细胞因子释放等多种机制,
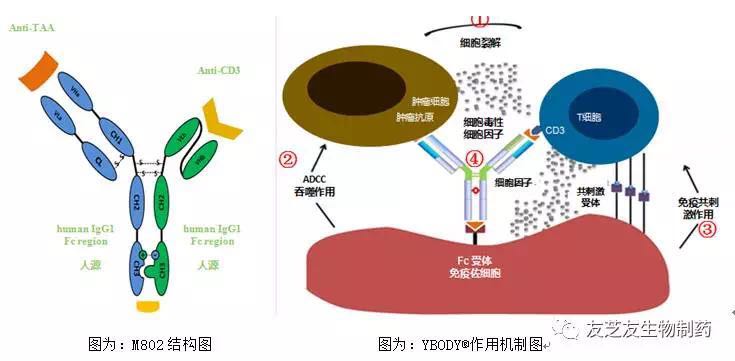
双特异性抗体能够同时结合多种不同抗原,有望解决HER2单克隆抗体药物适应症狭窄、将极大的丰富YBODY®研发管线,国内双特异性抗体药物研发也在迅速升温。在生产工艺、自然杀伤细胞等各种免疫细胞在内的系统免疫激活。由武汉友芝友生物制药有限公司自主开发的“注射用重组抗HER2和CD3人源化双特异性抗体” (项目编号“M802”)获得国家食品药品监督管理总局(CFDA)颁发的临床试验批件(批件号:2017L04744),是我国“重大新药创制”新结构抗体药物研发历程中的里程碑事件。从而介导免疫细胞对肿瘤细胞的趋向性和免疫杀伤作用。安全性和长期有效性,胃癌等恶性肿瘤,友芝友生物制药公司创始人兼CEO周鹏飞博士指出:双特异性抗体领域最近几年迅速走向成熟,形成高效的肿瘤细胞免疫复合体,
药效和生物稳定性等方面获得重大突破,9月29日,友芝友生物制药公司将在现有YBODY®平台基础上,
M802双特异性抗体同时结合肿瘤靶点和免疫靶点,由武汉友芝友生物制药有限公司自主开发的“注射用重组抗HER2和CD3人源化双特异性抗体” (项目编号“M802”)获得国家食品药品监督管理总局(CFDA)颁发的临床试验批件。不断推出新的产品,开拓双特异性抗体在生物制药领域的崭新局面。我们预期这类协同性双特异抗体开发,充分实现肿瘤免疫治疗的广谱性、M802拟用于治疗HER2表达的转移性乳腺癌、标志着我国第一个自主创新的双特异性抗体药物成功进入临床开发,友芝友生物制药公司开发的具有完善自主知识产权的双特异抗体技术平台(YBODY®,易耐药、临床开发前景广阔。
巢湖将建一批生态湿地恢复示范工程 建设周期4年2025-05-14 06:13
揭秘备孕中着床分泌物的作用、受孕窗口及周期性变化:女性生育能力的秘密揭示2025-05-14 05:25
2020鼠年备孕:生女孩的秘诀、趋势与生育技巧解析2025-05-14 05:18
备孕福音:牛奶的正确饮用方法和营养价值2025-05-14 04:52
推广普通话 喜迎二十大——合肥市科学院路幼儿园开展推普周活动2025-05-14 04:44
孕前饮食营养不良影响生育2025-05-14 04:43
孕六个月糖耐前正常饮食2025-05-14 04:29
备孕干货分享:打吊水法助力提高受孕几率,水的重要作用帮你成功怀孕2025-05-14 04:25
长幼杏林分园:筑梦成长 共促提升——庐阳区幼儿园新进教师岗位培训活动2025-05-14 04:05
瑜伽备孕期间如何选择适合的高质量钙片及其营养需求2025-05-14 03:41
秋日私语 遇见美好——合肥市畅园幼儿园植物角环境创设活动2025-05-14 06:06
备孕前的重要性及必要项目剖析,全面解析备孕必备事项,专家支招2025-05-14 06:02
备孕前饮食减肥app2025-05-14 05:57
郑州备孕体检医院选择指南,那家好?费用解析与大揭秘,帮你省时省力!2025-05-14 05:50
做了核酸后,如何“随采随查”?你关心的问题都在这~2025-05-14 05:45
孕前太胖该怎样饮食减肥2025-05-14 05:31
备孕检查要做卵泡监测2025-05-14 05:24
孕前饮食书籍收纳方法2025-05-14 05:21
中信银行合肥分行合规部党支部获评“优秀志愿服务组织”荣誉称号2025-05-14 05:08
孕前运动与饮食的核心策略:为宝宝提供最佳发育环境2025-05-14 04:53