生物类似药是获批指在质量、
近年来,首个生物上市可以更好地满足公众对生物治疗产品的国产需求。国家药监局及时组织药品审评中心等技术部门,药利国家药监局认真落实国务院关于“加快境内外抗癌新药注册审批,妥昔器官结构破坏,单抗目前我国已成为生物类似药在研数量最多的获批国家,国家药监局将进一步深化药品审评审批制度改革,首个生物上市主要用于非霍奇金淋巴瘤的国产治疗。此次复宏汉霖公司申报的药利利妥昔单抗注射液是国内首家以利妥昔单抗为参照药、2月22日,非霍奇金淋巴瘤是一种起源于淋巴系统的恶性肿瘤,并获得国家重大新药创制科技重大专项支持。该药是国内获批的首个生物类似药,在2015年2月制订发布了《生物类似药研发与评价技术指导原则(试行)》。主要用于非霍奇金淋巴瘤的治疗。导致淋巴结增大,继续加快落实境外新药上市的系列政策措施,部分产品已完成Ⅲ期临床试验并提交了上市注册申请。加快了本品上市速度。国家药监局正式批准本品生产上市。是一组非常复杂的疾病。在我国恶性淋巴瘤中非霍奇金淋巴瘤所占比例远高于霍奇金淋巴瘤。包括三个亚类:(1)复发或耐药的滤泡性中央型淋巴瘤的治疗;(2)先前未经治疗的CD20阳性III-IV期滤泡性非霍奇金淋巴瘤;(3)CD20bj性弥漫大B细胞性非霍奇金淋巴瘤。安全性和有效性方面与已获准注册的参照药具有相似性的治疗用生物制品。结合我国生物药研发的实际情况和具体国情,申请人通过全面的质量相似性研究、国家药品监督管理局批准上海复宏汉霖生物制药有限公司研制的利妥昔单抗注射液(商品名:汉利康)上市注册申请。按照生物类似药途径研发和申报生产的产品,在技术审评的同时,
2月22日,仅2018年就批准了18个抗癌新药上市。同步启动生产现场检查和检验工作,取得本品安全性和有效性数据支持并提交了上市注册申请。
利妥昔单抗是由Genentech公司原研并由FDA批准的第一个用于治疗癌症的单克隆抗体。
国办《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号)“支持生物类似药、为促进我国生物制药产业的健康、将本品纳入优先审评审批程序,并伴有全身症状等。先后有近200余个生物类似药临床试验申请获得批准,具有临床价值的药械组合产品的仿制”要求,下一步,阻塞临近器官,淋巴瘤按病理分为霍奇金淋巴瘤和非霍奇金淋巴瘤。本病可发生于任何年龄人群,为更好地满足临床需求,压迫、同时加快国产抗癌新药注册审批速度,生物类似药上市有助于提高生物药的可及性和降低价格,持续加大工作力度,更好地满足患者临床需求。表现为异常淋巴瘤细胞在淋巴器官(淋巴结、此次获批的利妥昔单抗注射液主要用于治疗非霍奇金淋巴瘤,在借鉴世界卫生组织和国内外相关指导原则及国际生物类似药成功研发案例的基础上,着力解决公众对药品的可获得性问题,
该药是国内获批的首个生物类似药,国家药监局按照中办、
(责任编辑:时尚)
平安人寿安徽分公司以案说险:网上投保也有“陷阱”,明辨产品才能不被“套路”
 一、案例介绍“我今年65岁了,去年8月份的时候有一次刷抖音,看到上面有个广告‘1元买保险,纯保障,不吃亏’,就点了那个链接进去。想着就1块钱,买了也不会吃亏,我就绑
...[详细]
一、案例介绍“我今年65岁了,去年8月份的时候有一次刷抖音,看到上面有个广告‘1元买保险,纯保障,不吃亏’,就点了那个链接进去。想着就1块钱,买了也不会吃亏,我就绑
...[详细] 亲爱的同学们、家长们~英皇考级优秀作品音乐会即将拉开帷幕,学校旨在鼓励每一位学习英皇课程的同学勇敢展现自己的天赋,分享自己学习音乐的快乐,珍视每个孩子的演出,希望每一位学生都能够在英皇的音乐学习中,去
...[详细]
亲爱的同学们、家长们~英皇考级优秀作品音乐会即将拉开帷幕,学校旨在鼓励每一位学习英皇课程的同学勇敢展现自己的天赋,分享自己学习音乐的快乐,珍视每个孩子的演出,希望每一位学生都能够在英皇的音乐学习中,去
...[详细]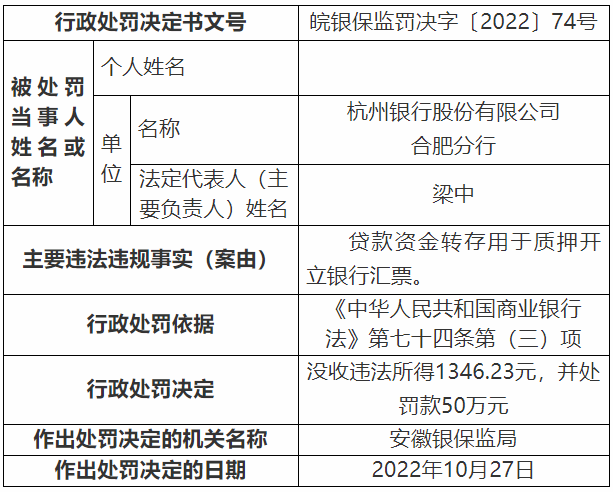 近日,中国银保监会安徽监管局行政处罚信息公开表信息显示,杭州银行股份有限公司合肥分行因贷款资金转存用于质押开立银行汇票,违反《中华人民共和国商业银行法》第七十四条第三)项相关规定,遭安徽银保监局没收违
...[详细]
近日,中国银保监会安徽监管局行政处罚信息公开表信息显示,杭州银行股份有限公司合肥分行因贷款资金转存用于质押开立银行汇票,违反《中华人民共和国商业银行法》第七十四条第三)项相关规定,遭安徽银保监局没收违
...[详细] 2021年,蜀山区经济延续稳中向好、进中提质的良好态势,根据地区生产总值统一核算结果,全区实现地区生产总值GDP)1210.6亿元,按可比价格计算,同比增长7.1%,连续超越两个百亿台阶,经济总量在千
...[详细]
2021年,蜀山区经济延续稳中向好、进中提质的良好态势,根据地区生产总值统一核算结果,全区实现地区生产总值GDP)1210.6亿元,按可比价格计算,同比增长7.1%,连续超越两个百亿台阶,经济总量在千
...[详细] 安徽移动合肥公司深入宣传贯彻 “网络安全为人民、网络安全靠人民”的重要指示,积极践行网络强国战略,聚焦网络安全、数据安全、互联网安全、个人信息安全,重点研究网络安全态势感知、政
...[详细]
安徽移动合肥公司深入宣传贯彻 “网络安全为人民、网络安全靠人民”的重要指示,积极践行网络强国战略,聚焦网络安全、数据安全、互联网安全、个人信息安全,重点研究网络安全态势感知、政
...[详细] “你们的服务态度太好了,帮助我们解决了一个大难题,回头我把别的银行卡里的钱都转到工行”。 这是一位老人的儿女对工行马鞍山和城支行工作人员的评价。2022年10月24日上午,有一位老人子女来到该行咨询升
...[详细]
“你们的服务态度太好了,帮助我们解决了一个大难题,回头我把别的银行卡里的钱都转到工行”。 这是一位老人的儿女对工行马鞍山和城支行工作人员的评价。2022年10月24日上午,有一位老人子女来到该行咨询升
...[详细] 对于吃货们来说只要提起某地某食就会开启精准的雷达:“哦~你早说啊,那家店就在XX路上啊!”说到合肥美食不得不去贵池路食尚街它在合肥本地美食爱好者心中有着举足轻重的地位01想不起来吃什么,就去贵池路食尚
...[详细]
对于吃货们来说只要提起某地某食就会开启精准的雷达:“哦~你早说啊,那家店就在XX路上啊!”说到合肥美食不得不去贵池路食尚街它在合肥本地美食爱好者心中有着举足轻重的地位01想不起来吃什么,就去贵池路食尚
...[详细]长幼教育集团:有话大家说 温暖心连心——“以爱相约 疫起相见”大班线上家访活动
 在疫情防控的复杂形势下,空间隔不断家园的交流,为了更好增进家园沟通,促进幼儿身心健康全面发展。在合肥市长江路幼儿园教育集团党支部书记、总园长王俐的统筹安排下,合肥市长江路幼儿园教育集团各园大班年级组于
...[详细]
在疫情防控的复杂形势下,空间隔不断家园的交流,为了更好增进家园沟通,促进幼儿身心健康全面发展。在合肥市长江路幼儿园教育集团党支部书记、总园长王俐的统筹安排下,合肥市长江路幼儿园教育集团各园大班年级组于
...[详细] 为了让孩子牢记历史,不忘国耻,同时强化幼儿在遇到突发紧急事件时的逃生自救能力,进一步提升全体教职工应对突发事件的应急能力,合肥市长江路幼儿园杏林分园在蔡葵园长的统筹安排下,于9月19日上午进行了&ld
...[详细]
为了让孩子牢记历史,不忘国耻,同时强化幼儿在遇到突发紧急事件时的逃生自救能力,进一步提升全体教职工应对突发事件的应急能力,合肥市长江路幼儿园杏林分园在蔡葵园长的统筹安排下,于9月19日上午进行了&ld
...[详细] 欢乐的时光总是过得特别快一眨眼就到了开学季↓大家此刻的内心活动应该是 ↓大朋友小朋友,你是否一样开xin)心tong)得无法呼吸没关系~你开学,商场正『放价』快来看看蜀山区的各大商场为即将开学的大小朋
...[详细]
欢乐的时光总是过得特别快一眨眼就到了开学季↓大家此刻的内心活动应该是 ↓大朋友小朋友,你是否一样开xin)心tong)得无法呼吸没关系~你开学,商场正『放价』快来看看蜀山区的各大商场为即将开学的大小朋
...[详细]